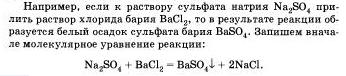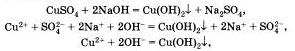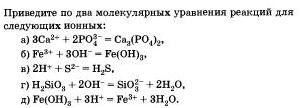Страницы сайта
Текущий курс
Участники
Курс неорганической химии
Ученикам. Как работать в системе Мооdle
Введение в предмет химии.
Глава 1. Атомы химических элементов
Глава 2. Простые вещества.
Глава 3. Соединения химических элементов
Глава 4. Изменения происходящие с веществами
Глава 5. Растворение. Растворы.
Глава 6
Тема 4. Ионные уравнения
Ионные уравнения
Большинство химических реакций протекает в растворах. Растворы электролитов содержат ионы, поэтому реакции и растворах электролитов фактически сводятся к реакциям между ионами.
Реакции между ионами называют ионными реакциями, а уравнения таких реакций - ионными уравнениями.
При составлении ионных уравнении следует руководствоваться тем. что формулы веществ малодиссоцвшрующих. нерастворимых и газообразных записываются в молекулярном виде.
Бели вещество выпадает в осадок, то рядом с его формулой ставят стрелку, направленную вниз, а если в ходе реакции выделяется газообразное вещество, то рядом с его формулой ставят стрелку, направленную вверх.
Перепишем это уравнение, изобразив сильные электролиты в виде ионов, а уходящие из сферы реакции - в виде молекул:
Мы записали, таким обратом, полное ионное уравнение реакции.
Если исключить из обеих частей равенства одинаковые ионы, то есть не участвующие в реакции в левой и правой часто уравнения), то получим сокращенное ионное уравнение реакции: ![]()
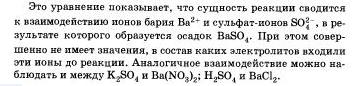
Таким образом, сокращенные ионные уравнения представляют собой уравнения в общем виде, которые характеризуют сущность химической реакции п показывают, какие ионы реагируют и какое вещество образуется в результате.
Реакции ионного обмена протекают до конца в тех случаях, когда образуется или осадок, или малодиссоциирующее вещество, например вода. Беля к раствору гидроксида натрия, окрашенного фенолфталеином в малиновый цвет, прилить избыток раствора азотной кислоты, то раствор обесцветится, что послужит сигналом протекания химической реакции: 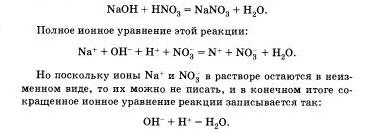
Оно показывает, что взаимодействие сильной кислоты п щелочи сводится к взаимодействию ионов Н+ и ионов ОН -, в результате которого образуется малодиссоцвирующее вещество — вода.
Указанная реакция взаимодействия сильной кислоты со щелочью называется реакцией нейтрализации. Это частный случай реакции обмена.
Подобная реакция обмена может протекать не только между кислотами и щелочами, но и между кислотами и нерастворимыми основаниями. Например, если получить голубой осадок нерастворимого гидроксида меди (II) взаимодействием сульфата меди і II і со щелочью:
а затем поделить полученный осадок на три части и прилить к осадку в первой пробирке раствор серной кислоты, к осадку во второй пробирке раствор соляной кислоты, а к осадку в третьей пробирке раствор азотной кислоты, то во всех трех пробирках осадок растворится. Это будет означать, что во всех случаях прошла химическая реакция, суть которой и отражена с помощью одного и того же ионного уравнения.
Чтобы в этом убедиться, запишите молекулярные, полные и сокращенные ионные уравнения приведенных реакций.
Рассмотрим ионные реакции, которые протекают с образованием газа. В две пробирки нальем по 2 мл растворов карбоната натрия и карбоната калия. Затем в первую прильем раствор соляной, а во вторую — азотной кислоты. В обоих случаях мы заметим характерное "вскипание" из-за выделяющегося углекислого газа. Запишем уравнения реакций для первого случая: 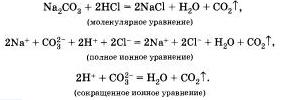
Реакции, протекающие в растворах электролитов, эапис каются с помощью ионных уравнений. Эти реакции называл реакциями ионного обмена, так как в растворах электролиты обмениваются своими ионами. Таким образом, можно сделать два вывода. 1. Реакции в водных растворах электролитов являются реакциями между ионами, а потому изображаются в виде ионных уравнений. Они проще молекулярных и носят более общий характер.
2. Реакции ионного обмена в растворах электролитов практически необратимо протекают только в том случае, если в результате образуется осадок, газ или малодиссоциирующее вещество.
1. Молекулярное и ионное уравнения реакций.
2. Реакции нониого обмена.
3. Реакции нейтрализации.
Запишите молекулярные и ионные уравнения реакций, о которых говорилось в первой части параграфа, — между сульфатом калия и нитратом бария, между серной кислотой н хлоридом бария. В чем суть обеих реакций?
Запишите молекулярное п ионное уравнения реакций, о которых говорилось во второй части параграфа. — между гидроксидом меди (II) и соляной кислотой, между гид-роксидом меди (II) и азотной кислотой. В чем суть обеих реакций?
Запишите молекулярное и ионное уравнения реакций между карбонатом калия и фосфорной кислотой. Что объединяет ату реакцию и те реакции, о которых говорилось в конце параграфа?
Предложите свои примеры ионных реакций, протекающих с образованием осадков, пользуясь таблицей растворимости. Уравнения реакций запишите в молекулярной и ионной формах.