Страницы сайта
Текущий курс
Участники
Курс неорганической химии
Ученикам. Как работать в системе Мооdle
Введение в предмет химии.
Глава 1. Атомы химических элементов
Глава 2. Простые вещества.
Глава 3. Соединения химических элементов
Глава 4. Изменения происходящие с веществами
Глава 5. Растворение. Растворы.
Глава 6
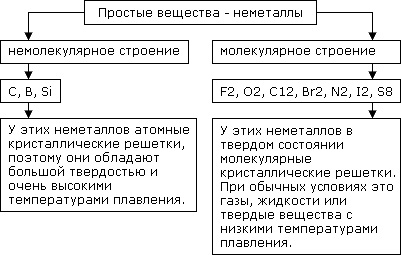
Тема 2. Простые вещества - неметаллы
Тема. Простые вещества — неметаллы
Цели урока:
- формировать представления о неметаллах, об их характерных отличиях от металлов.
Термины:
Неметаллы– химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами металлов.
Простые вещества - неметаллы
 Рис. 1. Периодическая система Д.И. Менделеева
Рис. 1. Периодическая система Д.И. Менделеева
Неметаллы – химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами металлов.
К неметаллам относятся инертные газы. Каждая молекула инертного газа состоит из одного атома.
Где гелий применяется в природе? 
Аллотропия
Способность атомов одного химического элемента образовывать несколько простых веществ называют аллотропией, а эти простые вещества – аллотропными видоизменениями или модификациями 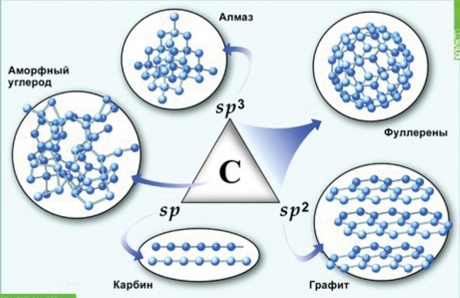 Рис. Аллотропия углерода
Рис. Аллотропия углерода 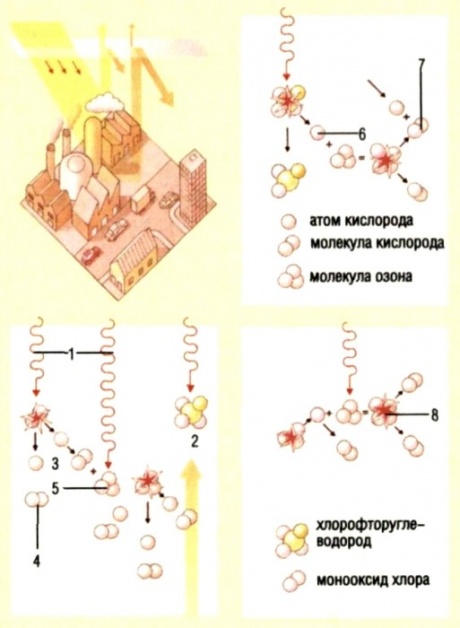 Рис. Аллотропия кислорода
Рис. Аллотропия кислорода
Домашнее задание
Составьте схемы строения электронной оболочки и схемы образования химической связи в следующих атомах и веществах:
• атом углерода и молекула кислорода;
• атом серы и молекула водорода
Интересно знать что ...
Кислород – самый распространенный химический элемент в земной коре. Кислород входит в состав почти всех окружающих нас веществ. Так, например, вода, песок, многие горные породы и минералы, составляющие земную кору, содержат кислород. Кислород является также важной частью многих органических соединений, например, белков, жиров и углеводов, имеющих исключительное значение в жизни растений, животных и человека. В 1772 г. шведский химик К.В. Шееле установил, что воздух состоит из кислорода и азота. В 1774 г. Д. Пристли получил кислород разложением оксида ртути (2). Кислород – бесцветный газ без вкуса и запаха, относительно мало растворим в воде, немного тяжелее воздуха: 1 л кислорода при нормальных условиях весит 1,43 г, а 1 л воздуха – 1,29 г. ( Нормальные условия – сокращенно: н. у. – температура 0 оС и давление 760 мм рт. ст., или 1 атм) . При давлении 760 мм рт. ст. и температуре – 183 оС кислород сжижается, а при снижении температуры до – 218,8 оС затвердевает. Химический элемент кислород О, кроме обычного кислорода О2 , существует в виде еще одного простого вещества – озона О3. Кислород О2 превращается в озон в приборе, называемом озонатором. Это газ с резким характерным запахом (название “озон” в переводе с греческого – “пахнущий”). Запах озона вы, вероятно, не раз ощущали во время грозы. Озон состоит из трех атомов элемента кислорода. Чистый озон – газ синего цвета, в полтора раза тяжелее кислорода, лучше его растворяется в воде. В воздушной атмосфере над Землей на высоте 25 км существует озоновый слой. Там озон образуется из кислорода под воздействием ультрафиолетового излучения Солнца. В свою очередь озоновый слой задерживает это опасное для всех живых существ излучение, что обеспечивает нормальную жизнь на Земле. Озон используют для обеззараживания питьевой воды, так как озон окисляет вредные примеси в природной воде. В медицине озон используют как дезинфицирующее средство