Страницы сайта
Текущий курс
Участники
Курс неорганической химии
Ученикам. Как работать в системе Мооdle
Введение в предмет химии.
Глава 1. Атомы химических элементов
Глава 2. Простые вещества.
Глава 3. Соединения химических элементов
Глава 4. Изменения происходящие с веществами
Глава 5. Растворение. Растворы.
Глава 6
Тема 3. Химические уравнения.
Химические уравнения
Закон сохранения массы веществ, открытый М. В. Ломоносовым в 1756 г., гласит:
Масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате ее.
Материальными носителями массы веществ являются атомы химических элементов, из которых состоят как вступившие в реакцию вещества (реагенты), так и образовавшиеся в результате ее новые вещества (продукты реакции). Поскольку при химических реакциях атомы не образуются н не разрушаются, а происходит лишь их перегруппировка, то становится очевидным справедливость открытого М. В. Ломоносовым и подтвержденного позднее А. Лавуазье закона.
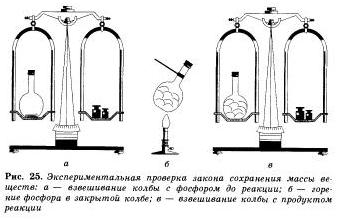
В справедливости закона сохранения массы веществ можно легко убедиться на простом опыте. Поместим в колбу немного красного фосфора, закроем ее пробкой и взвесим на весах. Затем колбу, осторожно нагреем.
О том, что произошла химическая реакция, нам станет понятно по появлению густого белого дыма в колбе, состоящего из оксида фосфора (V). который образовался при взаимодействии фосфора с кислородом. При повторном взвешивании колбы с продуктами этой реакции мы убедимся, что масса веществ в колбе не изменилась, хотя и произошло превращение фосфора в его оксид.
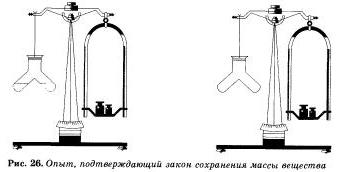
Этот же вывод будет нами сделан и при проведении еще одного простого, но очень наглядного опыта. В специальный сосуд нальем отдельно соляную кислоту и раствор щелочи, например гидрокспда натрия. К раствору щелочи добавим несколько капель индикатора — фенолфталеина, отчего раствор окрасится в малиновый цвет. Закроем прибор пробкой, уравновесим гирями на весах, отметим массу, а затем сольем растворы. Малиновая окраска исчезнет, потому что кислота и щелочь прореагировал и друг с другом. Масса же сосуда с полученными продуктами реакции не изменилась.
Аналогичное наблюдение сделал и автор закона М. В. Ломоносов, который проводил опыты в запаянных стеклянных сосудах, «дабы исследовать, прибывает ли вес металла от чистого жару», и обнаружил, что «без пропущения внешнего воздуха вес металлов остается в одной мере». На основании этого закона пишутся химические предложения, то есть составляются уравнения химических реакций с помощью химических слов — формул.
Химические уравнением называется условная запись химической реакции с помощью химических формул и математических знаков.
В левой чести уравнения записывают формулы (формулу) веществ, вступивших в реакцию, соединяют их знаком плюс. В правой части уравнения записывают формулы (формулу) образующихся веществ, также соединенных знаком плюс. Между частями уравнения ставят стрелку. Затем находят коэффициенты — числа, стоящие перед формулами веществ, чтобы число атомов одинаковых элементов в левой и правой частях уравнения были равны. Запишем, например, следующее уравнение реакции: ![]()
Так как число атомов кислорода в первой части вдвое больше, чем в левой, запишем перед формулой воды коэффициент 2: 2Н2О —> Н2 + О2
Но теперь в левой частя уравнения стало четыре атома водорода, а в правой их осталось два. Чтобы уравнять число атомов водорода, запишем перед его формулой в правой части также коэффициент 2. Так как мы уравняли число атомов каждого элемента в левой и правой частях уравнения, заменим стрелку на знак равенства: 2H2O = 2Н2 + О2
Теперь, наверное, вам понятно, почему такая запись называется уравнением.
С помощью уравнений химических реакций можно определить и тип реакции. Так, рассмотренная выше реакция относится к реакция я разложения, то есть таким, при которых ил одного сложного вещества образуются два и более новых простых или сложных вещества, но более простого состава.
При разложении, например, гидроксида железа (III) образуются оксид железа (III) и вода:
Химические реакции противоположного типа называются реакциями соединения. В реакции соединения вступают одно или несколько простых или сложных веществ, из которых образуется одно более сложное вещество.
Например, водород и кислород при горении, соединяясь, образуют воду: ![]()
К реакциям соединения относится и рассмотренная ранее нами реакция получения сульфида железа (II) из порошков серы и железа. Интересно отметить, что реакции соединения и реакции разложения сопровождаются противоположными тепловыми эффектами: реакции соединения чаще относятся к экзотермическим, а реакции разложения — к эндотермическим.
Если в раствор сульфата меди (ІІ) опустить железную скрепку, то очень скоро она покраснеет из-за выделившейся на ней меди, а в раствор перейдет сульфат железа (II): CuSO4+Fe= FeSO4 + Cu
Мы записали уравнение реакции замещения, то есть такой реакции, при осуществлении которой атомы простого вещества замещают атомы одного нэ элементов а сложном веществе.
В результате этой реакции образуются два новых вещества — простое и сложное.
К реакция обмена относятся такие реакции, при которых два сложных вещества обмениваются своими составными частями.
Например, к раствору медного купороса сульфата меди (II) прильем несколько капель раствора едкою натра — гидроксида натрия, выпадает голубой осадок гидроксида меди (II). При этом образуется еще одно сложное вещество — растворимая соль сульфат натрия:
![]() Если к полученному осадку прилить раствор серной кислоты, то мы заметим растворение полученного осадка в результате другой реакции обмена:
Если к полученному осадку прилить раствор серной кислоты, то мы заметим растворение полученного осадка в результате другой реакции обмена:
Cu(OH)2 + H2SO4 = CuSO4 + 2HOH
Следовательно, уравнение химической реакции показывает, какие вещества вступают во взаимодействие и какие вещества при этом образуются, в каких количественных отношениях они находятся и какого типа эта реакция.
Например, уравнение 4Al + 3O2 = 2Al2O3
показывает, что в результате реакции соединения четыре моля алюминия взаимодействуют с тремя молями кислорода и образуют при этом два моля оксида алюминия.
1. Химические уравнения.
2. Реакции разложения.
3. Реакции соединения.
4. Реакции замещения.
5. Реакции обмена.
Запишите в виде химических уравнений следующие предложения: а) При обжиге карбоната кальция образуются оксид кальция и оксид углерода (IV)
б) При взаимодействии оксида фосфора (V) с водой получается фосфорная кислота. Каков тип указанных реакций? Какая из них будет экзо-, а какая эндотермической?
Составьте уравнения по следующим схемам и укажите тип реакции: 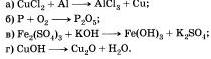
Под формулами веществ напишите их названия. Запишите уравнения химических реакций по следующим схемам:
а) фосфорная кислота + гидроксид натрия —> фосфат натрия + вода; б) оксид натрия + вода —> гидроксид натрия; в) оксид железа (II) + алюминий —> оксид алюминий + железо; г) гидроксид меди (II) —> оксид меди (II) + вода.
Укажите тип реакции. Что показывает уравнение следующей химической реакции: Какое количество водорода взаимодействует с 1 моль оксида железа (III)? Какой обьем водорода взаимодействует с 1 моль оксида железа (III)? Какое количество железа при этом образуется? Сколько молекул воды при этом получается?