Страницы сайта
Текущий курс
Участники
Курс неорганической химии
Ученикам. Как работать в системе Мооdle
Введение в предмет химии.
Глава 1. Атомы химических элементов
Глава 2. Простые вещества.
Глава 3. Соединения химических элементов
Глава 4. Изменения происходящие с веществами
Глава 5. Растворение. Растворы.
Глава 6
Тема 4. Химические формулы. Относительная атомная и молекулярная масса
Тема. Химические формулы. Относительная атомная и молекулярная массы.
Цель урока
- объяснить ученикам, что означают химические формулы, а также понятия относительной атомной и молекулярной массы
Термины и определения
- Химические формулы - характеризируют не только структуру вещества, а и его массу и количество.
- Атомная единица массы - равняется 1/12 массы одного атома углерода 12С.
- Относительная атомная масса – это величина, не имеющая размера, которая равняется отношению средней массы одного атома химического элемента к 1/12 массы одного атома 12С.
- Абсолютная масса - равна относительной атомной массе, умноженной на 1 а.е.м.
- Относительная молекулярная масса – это величина, не имеющая размера, которая равняется отношению массы одной молекулы химического вещества к 1/12 массы одного атома 12С.
- Абсолютная масса молекулы - равняется относительной молекулярной массе, умноженной на 1 а.е.м.
Ход урока
Часть 1. Химические формулы.
Химическая формула - это условная запись качественного и количественного состава вещества при помощи химических знаков и индексов.

Индекс - это цифра в химической формуле, которая ставится внизу после химического знака и обозначает число атомов данного вида.
Качественный состав молекулы показывает какие виды атомов входят в состав вещества.
Количественный состав показывает сколько атомов определённого вида входит в состав молекулы вещества.
Числа стоящие перед химическими формулами или химическими знаками называются коэффициентами. Коэффициенты показывают число атомов или молекул определённого вида.

Что обозначают записи?
H2- это одна молекула водорода (аш-два), в её состав входят два атома водорода.
5O2 - это пять молекул кислорода (пять-о-два), в состав одной молекулы входят два атома кислорода.
6Fe - это шесть атомов железа (шесть-феррум).
3H2SO4 - это три молекулы серной кислоты (три-аш-два-эс-о-четыре), в состав одной молекулы серной кислоты входят два атома водорода, один атом серы, четыре атома кислорода.
Видео 1. Горение фосфора в кислороде.
Часть 2. Относительная атомная масса.
Атомная единица массы элемента равняется 1/12 массы одного атома углерода 12 ат С.
1 а.е.м. = 1/12m (12С) = 1,66057 10-27кг = 1,66057 10-24г.
Относительная атомная масса химического элемента (обозначающаяся Ar) – это величина, не имеющая размера, которая равняется отношению средней массы одного атома химического элемента к 1/12 массы одного атома 12С.
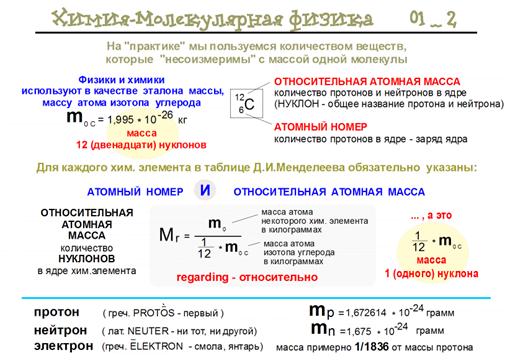
Абсолютная масса одного атома химического элемента равна относительной атомной массе, умноженной на 1 а.е.м.: m(Cl)= 35,453 1,66057 10-24 =5,8872 10-23г.
Контрольные вопросы.
1. Какая система используется для вычисления массы атомов и молекул?
2. Как определяется атомная единица массы химического элемента?
3. Как рассчитывается относительная атомная масса химического элемента?
Часть 3. Относительная молекулярная масса.
Относительная молекулярная масса (Mr)- безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C.
Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
Примеры:
Mr(B2O3) = 2 · Ar(B) + 3 · Ar(O) = 2 · 11 + 3 · 16 = 70
Mr(KAl(SO4)2) = 1 · Ar(K) + 1 · Ar(Al) + 1· 2 · Ar(S) + 2· 4 · Ar(O) = 1 · 39 + 1 · 27 + 1 · 2 · 32 + 2 · 4 ·16 = 258
УПРАЖНЕНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ ТЕМЫ
№1. Вычислите относительные молекулярные массы следующих веществ: NaOH, CuCl2, HNO3
№2. Напишите, что обозначают следующие записи, в скобках указаны названия незнакомых веществ:
4S, 7H2O, 4O3 (озон), 2NaCl (поваренная соль), 3H2CO3 (угольная кислота),6C12H22O11 (сахар)?
РАБОТАЙТЕ С ТРЕНАЖЕРАМИ
Домашнее задание
1.Вычислите относительные атомные и молекулярные массы воды, кислорода и золота.
Интересно знать, что…
С обугливанием органических веществ (например, древесины) приходится встречаться довольно часто. Все органические вещества всегда имеют в своем составе элемент Карбон, который существует в природе в виде алмаза и графита. Почти чистым углеродом является также древесный уголь, сажа. В состав сахара входят три химических элемента: Карбон, Водород и Оксиген. При нагревании сахар обугливается, теряя водород и кислород, которые выделяются в виде воды. Однако, такое выделение воды можно сделать не только нагревая сахар, а также и другим путем, например, используя для этого концентрированную серную кислоту. Концентрированная серная кислота чрезвычайно жадно присоединяет к себе воду и может забирать ее от многих соединений. Этим объясняется обугливающее действие серной кислоты на древесину, бумагу, сахар и т.д. Разотрите в мелкий порошок 40 г сахара и высыпьте его в узкий стакан, добавьте около 3-4 мл воды и хорошо перемешайте стеклянной палочкой. Поставьте стакан на тарелку, добавьте 20-25 мл концентрированной серной кислоты и снова хорошо перемешайте смесь. Через несколько минут смесь начнет темнеть, разогреваться, из стакана выходить водяной пар и начнет образовываться рыхлая масса, которая поднимется из стакана в виде столба. Масса, которая образуется при этом, представляет собой очень пористый уголь, полученный из сахара. При реакции выделяется также и серы (IV) оксид, который образуется вследствие восстановления серной кислоты углем. Образующиеся при реакции газы и пары воды вызывают вспучивание обугленного сахара

